BIOQUIMICA
Es una ciencia que estudia la química de la vida; es decir, pretende describir la estructura, la organización y las funciones de la materia viva en términos moleculares.
Puede dividirse en tres áreas principales:
1) La química estructural de los componentes de la materia viva y la relación de la función biológica con la estructura química
2) El metabolismo, la totalidad de las reacciones químicas que se producen en la materia viva
3) La química de los procesos y las sustancias que almacenan y transmiten la información biológica. Esta última también es el área de la genética molecular.
La bioquímica es una ciencia interdisciplinar, ya que extrae sus temas de interés de muchas disciplinas tales como la química orgánica, biofísica, medicina, nutrición, microbiología, fisiología biología celular y genética.
Bioquímica moderna
Bioquímica ciencia dinámicas desde 100 años.
Siglo XX: Bioquímica como cinética de reacción y composición atómica de las moléculas
Siglo XIX: Se identifica número de sustancias químicas producidas por los organismos vivos.
1828: Friedrich Wohler Sintetizó el compuesto orgánico “urea” al calentar compuesto inorgánico cianato de amonio, mucho que a partir de sustancias inorgánicas comunes es posible sintetizar compuestos orgánicos vivos.
Descubrimientos:
1. Identificación de enzimas como catalizadores de reacciones biológicas por :
EDUARD BUCHNER: demuestra que los extractos de levaduras libes de células podrán catalizar la fermentación de la glucosa para convertirla en alcohol y dióxido de carbono
EMIL FISHER: “La Hidrolisis” de la sacarosa. Durante una Estudio a la naturaleza de catalizadores biológicos. Efecto catalítico de las enzimas de la levadura en una reacción simple catálisis una enzima y su reactante o sustrato se combinan y forman compuestos intermediarios, Propuso que solo una molécula con estructuras adecuadas perteneciente a la determinando enzima.
Siglo XX (la mitad) : Avance en biología estructural.
1950-1960: Se explica la primera estructura de la proteína, es aquí donde se determina la forma tridimensional de múltiples estructuras. Cooperación de computadoras grandes y rápidas (programas de computación.)
2. Identificación de ácido nucleicos como moléculas de información.
Se realizó experimentos donde el ADN es el material genético:
1953: James D Watson y Francis H.C.Crick
- Dedujeron estructura tridimensional del ADN
- Posterior investigación que demuestra que la información codificada en el ADN se descubre el Ácido ribonucleico ADN y después se traduce en proteína.
- ADN----ARN----proteína
Crick 1958 :
- Flujo normal del ácido nucleico a la proteína reversible.
- Este flujo de información unidireccional como el Dogma central de la Biología Molecular.
Los elementos químicos de la vida
Los elementos importantes encontrados en las células vivas :
Los elemento más abundantes: CHNOPS
Los iones esenciales: Na, Mg, K, Ca, Cl
Los mas comunes: Mn, Fe, Co, Cu, Zn.
Los menos comunes: V,Cr, Mo, Ni. Ga, Al, B,Ga, Si, Sn, As, Se,I, F
Los iones esenciales: Na, Mg, K, Ca, Cl
Los mas comunes: Mn, Fe, Co, Cu, Zn.
Los menos comunes: V,Cr, Mo, Ni. Ga, Al, B,Ga, Si, Sn, As, Se,I, F
Enfoque de la bioquímica
Es de gran importancia poseer conocimiento de química orgánica para entender la bioquímica.
Los químicos orgánicos están más interesados en las reacciones que tienen lugar en el laboratorio, mientras que los bioquímicos se enfocan en comprender lo que ocurre en las reacciones dentro de las células vivas.
Los químicos orgánicos están más interesados en las reacciones que tienen lugar en el laboratorio, mientras que los bioquímicos se enfocan en comprender lo que ocurre en las reacciones dentro de las células vivas.
Las reacciones bioquímicas incluyen uniones químicas específicas o partes de moléculas denominadas grupos funcionales. Los más importantes sitios de reactividad.
Todas las uniones están compuestas por diferentes átomos y enlaces individuales entre átomos como: compuestos, grupos funcionales, por ejemplo :
Los enlaces éster y éter son comunes en los ácidos grasos y los lípidos.
Los enlaces amida se presentan en las proteínas.
Los enlaces éster fosfato y fosfoanhídrido se presentan en los nucleótidos.
Un punto importante para la bioquímica es que: las reacciones químicas que ocurren dentro de la célula son similares a las reacciones que tienen lugar en un laboratorio químico.
La diferencia más importante radica en que casi todas las reacciones que ocurren en las células vivas son catalizadas por enzimas y por lo tanto ocurren a velocidades muy altas.
Muchas macromoléculas son importantes son polímeros
Macromoléculas biológicas:
Forman polímeros creado por la unión de muchas moléculas orgánicas más pequeñas o monómeros por medio de condensación.
La energética de la vida
Las actividades de los organismos vivientes de las biomoléculas descritas en la sección anterior y también de una multitud de moléculas más pequeñas y de iones que se encuentran en las células.
La descomposición de compuestos orgánicos tanto en organismos fotosintéticos como no fotosintéticos libera energía que se puede utilizar para impulsar la síntesis de nuevas moléculas y macromoléculas.
La fotosíntesis
Es uno de los procesos bioquímicos clave y esenciales para la vida.
Uno de los subproductos de la fotosíntesis es el oxígeno.
Existe un conjunto de reacciones que capturan la luz del sol y la utilizan para sintetizar biopolímeros.
Es uno de los procesos bioquímicos clave y esenciales para la vida.
Uno de los subproductos de la fotosíntesis es el oxígeno.
Existe un conjunto de reacciones que capturan la luz del sol y la utilizan para sintetizar biopolímeros.
Metabolismo:
Se refiere a la gran cantidad de reacciones en virtud de las cuales los compuestos orgánicos se sintetizan y degradan y mediante el que la energía útil se extrae, almacena y utiliza.
Se refiere a la gran cantidad de reacciones en virtud de las cuales los compuestos orgánicos se sintetizan y degradan y mediante el que la energía útil se extrae, almacena y utiliza.
Bioenergética:
Estudio de los cambios en la energía durante las reacciones metabólicas
Esta es parte del campo de la termodinámica (estudia los cambios energéticos)
Los bioquímicos han descubierto que los principios básicos de la termodinámica que se aplican al flujo de energía en sistemas no vivos también son aplicables a la química de la vida.
Estudio de los cambios en la energía durante las reacciones metabólicas
Esta es parte del campo de la termodinámica (estudia los cambios energéticos)
Los bioquímicos han descubierto que los principios básicos de la termodinámica que se aplican al flujo de energía en sistemas no vivos también son aplicables a la química de la vida.
La velocidad de una reacción química
Cantidad de sustancia formada (si tomamos como referencia un producto) o transformada (si tomamos como referencia un reactivo) por unidad de tiempo.
La velocidad de reacción no es constante.
Al principio, cuando la concentración de reactivos es mayor, también es mayor la probabilidad de que se den choques entre las moléculas de reactivo, y la velocidad es mayor. a medida que la reacción avanza, al ir disminuyendo la concentración de los reactivos, disminuye la probabilidad de choques y con ella la velocidad de la reacción.
La medida de la velocidad de reacción implica la medida de la concentración de uno de los reactivos o productos a lo largo del tiempo, esto es, para medir la velocidad de una reacción necesitamos medir, bien la cantidad de reactivo que desaparece por unidad de tiempo, bien la cantidad de producto que aparece por unidad de tiempo.
La velocidad de reacción no es constante.
Al principio, cuando la concentración de reactivos es mayor, también es mayor la probabilidad de que se den choques entre las moléculas de reactivo, y la velocidad es mayor. a medida que la reacción avanza, al ir disminuyendo la concentración de los reactivos, disminuye la probabilidad de choques y con ella la velocidad de la reacción.
La medida de la velocidad de reacción implica la medida de la concentración de uno de los reactivos o productos a lo largo del tiempo, esto es, para medir la velocidad de una reacción necesitamos medir, bien la cantidad de reactivo que desaparece por unidad de tiempo, bien la cantidad de producto que aparece por unidad de tiempo.
Termodinámica
Si se conocen los cambios de energía vinculados a una reacción o proceso es posible predecir las concentraciones en equilibrio.
También se puede predecir la dirección de la reacción siempre que se conozcan las concentraciones iniciales de reactivos y productos.
También se puede predecir la dirección de la reacción siempre que se conozcan las concentraciones iniciales de reactivos y productos.
La cantidad termodinámica que proporciona esta información es la energía libre de Gibbs (G), llamada así por J. Willard Gibbs, quien describió por primera vez esta cantidad en 1878.
Sucedió que las moléculas en disolución tenían una cierta energía que dependía de la temperatura, la presión, la concentración y otros estados. El cambio en la energía libre de Gibbs (¢G) para una reacción es la diferencia entre la energía libre de los productos y la energía libre de los reactivos.
El cambio global en la energía libre de Gibbs tiene dos componentes conocidos como cambio de entalpía (¢H, el cambio en el contenido calorífico) y cambio de entropía (¢S, el cambio en la aleatoriedad).
Un proceso químico puede generar calor o absorberlo de sus alrededores. De manera similar, un proceso puede ocurrir con un incremento o disminución en el grado de desorden, o aleatoriedad, de los reactivos.
Bioquímica y evolución
Los bioquímicos y los biólogos moleculares han realizado contribuciones muy importantes para la comprensión de la evolución molecular.
La evidencia que han descubierto confirma y extiende los datos extraídos de la anatomía comparativa, la genética poblacional y la paleontología.
Se lleva recorrido un largo trayecto desde la evidencia original de la evolución que Carlos Darwin resumió por primera vez a mediados del siglo XIX. Ahora se cuenta con una descripción muy confiable de la historia de la vida y de las relaciones de muchas especies diversas en existencia. Los primeros organismos fueron organismos unicelulares que probablemente ahora se clasificarían como procariotas. Los procariotas, o bacterias, carecen de la membrana que rodea al núcleo.
La importancia de la evolución para un completo entendimiento de la bioquímica:
En el contexto molecular, la evidencia de esta evolución está preservada en las secuencias de genes y proteínas que se habrán de estudiar a medida que se aprende bioquímica. Con el fin de comprender por completo los principios fundamentales de la bioquímica se requiere examinar las rutas y procesos en diferentes especies, incluidas las bacterias y organismos modelos eucarióticos, así como una variedad de organismos de modelos eucarióticos como la levadura, las moscas de fruta, las plantas de floración, los ratones y los humanos.
La importancia de la bioquímica comparada ha sido reconocida durante más de 100 años, pero su valor se ha incrementado en gran medida en la última década con la publicación de secuencias genómicas completas.
Ahora existen condiciones para comparar rutas bioquímicas completas de diversas especies:
Bioquímica  multidisciplinaria
multidisciplinaria
Una de las metas de los bioquímicos es integrar un gran cuerpo de conocimiento para conformar una explicación molecular de la vida. Esto ha sido, y continúa siendo, una tarea desafiante. Sin embargo, los bioquímicos han realizado grandes avances hacia la definición de las reacciones básicas comunes a todas las células y han entendido cómo están interrelacionadas estas reacciones.
La bioquímica como disciplina no existe en un vacío. Ya se vio cómo la física, la química, la biología celular y la evolución contribuyen a una comprensión de la bioquímica. Las disciplinas relacionadas, como la fisiología y la genética, también son importantes. De hecho, muchos científicos ya no se consideran a sí mismos simplemente biólogos sino que son reconocidos en varios campos relacionados. Como todos los aspectos de la bioquímica están interrelacionados, es difícil presentar un tema sin referirse a los demás.
FUENTE DE VIDA : EL AGUA
Importancia biológica:
En la mayor parte, de las células, el agua es la molécula más importante y forma el 60 y 90% de su masa a excepción de las esporas y semillas. Todo el metabolismo de la célula opera en un ambiente acuoso porque el agua es: un solvente esencial y también sustrato de numerosas reacción celulares.
El agua, tiene unas características especiales obtenidas de su propia composición molecular. El agua está constituida por dos átomos de hidrogeno y uno de oxígeno.
Los enlaces que unen estos 3 átomos son enlaces covalentes, lo que quiere decir que los átomos intercambian electrones en las ultimas orbitas de cada átomo, pero en el caso del agua, el oxígeno tiene tanta cantidad de protones en su núcleo que su atracción no deja que los electrones viajen mucho por fuera, por lo que no se produce mucho intercambio, y esta propiedad se conoce como polaridad. El agua se suele considerar un líquido polar, puede disolver electrolitos cristalinos. Las moléculas de agua forman esferas de solvatación entorno a cada ion disuelto.
La abundancia del agua en las células y tejidos de todo los grande organismos multicelulares evidencia que las fluctuaciones de temperatura dentro de la célula se minimizan con una gran importancia biológica critica ya que la velocidad de la mayor parte de las reacciones bioquímicas son sensibles a la temperatura.
El agua tiene una función directa con nuestro organismo, tal es el caso del comportamiento de los solutos en el citoplasma, es distinto del que tienen en una sencilla solución en agua.
Para enfocarnos mejor hablaremos de las interacciones no covalentes: Puentes de Hidrogeno e interacciones hidrofóbicas. Interacciones débiles como estas juegan papel de extrema importancia de las estructuras funciones de las macromoléculas
Ejemplo: Las fuerzas débiles son la responsables de estabilizar la estructuras de las proteínas y de los ácidos nucleicos.
También las fuerzas débiles interviniente en el reconocimiento de una macromolécula por parte de otra y en la unión de los reactivos a las enzimas. Existen cuatro enlaces o fuerzas no covalentes principales que interviene en la estructuras y la función de la biomoléculas: los puentes de hidrógenos y la hidrofobicidad también hay interacciones entre carga y carga, y fuerzas de Van Der Waals.
Me enfoco a la función del agua en las macromoléculas en nuestro organismo ya que son de suma importancia, la estructura de cada una de ellas permite que cumplan una función que las diferencia de las otras. Se habla de tres grandes tipos: carbohidratos, lípidos y proteínas. Estas sustancias pueden ser encontradas en los alimentos consumimos diariamente y mediante procesos metabólicos en el interior del organismo pueden ser descompuestas en moléculas más sencillas con el objetico de brindar la energía necesaria al cuerpo.
Esta solubilidad del agua le confiere un carácter biológico muy necesario para las reacciones vitales como la respiración, el trasporte de la sangre etc. El agua al poseer tantos enlaces de hidrogeno tiene la capacidad de tomar el calor con mucha facilidad y calentarse, pero una vez caliente, tarda más en enfriarse, y esta característica es esencial para el medio ambiente y los procesos biológicos necesarios para la vida, donde el cuerpo necesita estar siempre a la misma temperatura, y cualquier variación puede ocasionar problemas o incluso la muerte.
Es por ende que el agua, es de suma importancia para el ser humano y el medio ambiente (flora y fauna) para poder subsistir, porque es el motor que impulsa cada parte de nuestro organismo.
La molécula de agua es polar
La molécula de agua (H2O) tiene forma de
V y el ángulo entre los dos enlaces
covalentes O—H es de 104.5°.
Algunas propiedades importantes del agua se deben a
la forma angulada y a los enlaces intermoleculares que puede formar.
La estructura y las propiedades del agua se pueden
explicar mejor si se supone que los electrones de la capa externa ocupan cuatro
orbitales híbridos sp3.
Dipolo: Los átomos de oxígeno son más
electronegativos que los de hidrógeno. El resultado es que se suscita una
distribución desigual de cargas dentro de cada enlace O—H en la molécula de
agua, con el oxígeno teniendo una carga negativa parcial y el hidrógeno con una
carga positiva parcial. Se dice que el enlace es polar
La polaridad de una molécula depende tanto de la
polaridad de sus enlaces covalentes como de su geometría.
Consecuencia de la polaridad de una molécula de agua es que dichas moléculas
se atraen entre sí.
Puentes de hidrogeno en el agua
Dos moléculas de agua, el átomo de hidrógeno
permanece enlazado covalentemente a su átomo de oxígeno que es el donador de
hidrógeno. Al mismo tiempo, está unido a otro átomo de oxígeno, llamado aceptor
de hidrógeno. La distancia del átomo de hidrógeno al átomo de oxígeno aceptor
tiene más o menos una longitud del doble que la del enlace covalente.
El agua no es la única molécula capaz de formar
puentes de hidrógeno; estas interacciones (puente de hidrogeno) pueden existir
entre cualquier átomo electronegativo y un átomo de hidrógeno unido a otro
átomo electronegativo
Los puentes de hidrógeno son mucho más débiles que
los enlaces covalentes típicos.
La orientación es importante, porque un puente de hidrógeno es más estable
cuando el átomo de hidrógeno y los dos átomos electronegativos asociados a él
(los dos átomos de oxígeno, en el caso del agua) forman casi una línea recta.
Una sola molécula de agua puede formar puentes de
hidrógeno hasta con otras cuatro moléculas de agua.
La densidad de la mayor parte de las sustancias
aumenta al congelarse, cuando se desacelera el movimiento molecular y se forman
cristales densamente empacados.
El agua es un solvente excelente.
Las
sustancias iónicas polares se disuelven en agua
El agua puede interactuar y disolver otros
compuestos polares y compuestos que se ionizan. La ionización se relaciona con
la ganancia o pérdida de un electrón, que da lugar a un átomo o a un compuesto
que presenta una carga neta.
El resultado de sus interacciones con moléculas de
agua es que los iones del cristal se continúen disociando hasta que la solución
se satura. En este momento, los iones del electrólito disuelto están presentes
en concentraciones suficientemente altas para que se vuelvan a unir al
electrólito sólido, cristalizándose, hasta que se establece el equilibrio entre
disociación y cristalización.
La cantidad de grupos polares en una molécula
afecta su solubilidad en agua.
También la solubilidad depende de la relación entre
grupos polares y no polares en una molécula
Al aumentar la cantidad de grupos polares en una
molécula orgánica, se incrementa su solubilidad en el agua.
Concentraciones celulares y difusión:
Una de las diferencias más importantes es la
reducción de la velocidad de difusión dentro de las células. Hay tres razones
por las que los solutos se disuelven con más lentitud en las células.
1. La viscosidad del citoplasma es mayor que
la del agua, lo que se debe a la presencia de numerosos solutos, como los
azúcares. De acuerdo con mediciones recientes parece que la viscosidad del
citoplasma sólo es un poco mayor que la del agua, aun en los organelos
empacados densamente.
2. Las moléculas con carga se enlazan
momentáneamente entre sí dentro de las células y ello restringe su movilidad.
Dichas consecuencias de la unión ejercen un efecto pequeño, pero apreciable,
sobre las tasas de difusión.
3. Los choques con moléculas de agua inhiben
la difusión a causa de un efecto que se denomina hacinamiento molecular. Es la
principal razón por la que se desacelera la difusión en el citoplasma.
Para las moléculas pequeñas, la velocidad de
difusión dentro de las células es más o menos la cuarta parte de la que
muestran en agua pura
Presión Osmótica
La presión osmótica de una solución depende de la
concentración molar total del soluto y no de su naturaleza química.
Las concentraciones de soluto dentro de la
célula son mucho mayores que su concentración en el ambiente acuoso fuera de la
célula. Las muchas moléculas tienden a través la membrana célula para
entrar a la célula y diluir la solución en el interior de esta.
Las sustancias no polares insolubles en agua.
Los hidrocarburos y otras sustancias no polares
presentan una solubilidad muy baja en agua porque las moléculas de agua
tienden a interactuar con otras moléculas de agua y no con moléculas no polares
Se dice que las moléculas no polares son
hidrofóbicas (que “odian” al agua) y a este efecto de exclusión de sustancias
no polares por parte del agua se le llama efecto hidrofóbico.
Los detergentes, a los que a veces se les llama
surfactantes o agentes tensoactivos, son moléculas que son hidrofílicas e
hidrofóbicas a la vez; en general cuentan con una cadena hidrofóbica de al
menos 12 átomos de carbono de longitud y un extremo iónico o polar. Se dice que
esas moléculas son anfipáticas.
Los caótropos aumentan la solubilidad en
agua de compuestos no polares porque desordenan a las moléculas de agua. Iones
como: SCN (tiocinato) y CIO4 ( perclorato) se solvatan mal en
comparación con NH4, SO4 Y H2PO.
El agua es nucleófilica.
El átomo de oxígeno, rico en
electrones, determina gran parte de la reactividad del agua en las reacciones
químicas.
A
las sustancias ricas en electrones se les llama nucleófilos (“amantes” del
núcleo) porque buscan especies con carga positiva, o con deficiencia en
electrones, llamadas electrófilos (“amantes” del electrón).
Los nucleófilos pueden tener carga
negativa o contar con pares no compartidos de electrones. Atacan a los
electrófilos durante reacciones de sustitución o de adición. Los átomos
nucleófilos más comunes en biología son de oxígeno, nitrógeno, azufre y
carbono.
Aunque el agua es un nucleófilos
relativamente débil, su concentración celular es tan alta que cabe esperar que
muchas macromoléculas sean degradadas fácilmente por le ataque nucleofilico del
agua.
Escala de Ph
El pH se define como el logaritmo
negativo de la concentración de H:
En el agua pura, [H_] = [OH_] = 1.0 -10 7 M
.
Se dice que el agua pura es
“neutra” con respecto a la carga iónica total ya que la concentración de
los iones hidrógeno con carga positiva y la de los iones hidróxido con carga
negativa es igual.
Las soluciones neutras tienen un
valor de pH igual a 7.0 porque el valor negativo del log(10 7) es 7.0. Las
soluciones ácidas tienen un exceso de H debido a la presencia de soluto
disuelto que suministra iones H
Las soluciones básicas tienen
valores de pH mayores que 7.0 y las soluciones ácidas tienen valores de pH
menores que 7.0.
A veces la medición del pH facilita
el diagnóstico de las enfermedades.
Constantes de disociación de ácidos
débiles
Los ácidos y bases
que se disocian por completo en agua, como el ácido clorhídrico y el hidróxido
de sodio, se llaman ácidos fuertes y bases fuertes. Hay muchos otros ácidos y
bases, como por ejemplo los aminoácidos que forman las proteínas y las purinas
y pirimidinas del ADN y ARN, que no se disocian por completo en el agua. A
dichas sustancias se les conoce como ácidos débiles y bases débiles.
Los ácidos y
las bases siempre existen en pares porque por cada donador de protón debe haber
un aceptador de protón. Ambos lados de la reacción de disociación deben
contener un ácido y una base.
La constante de
equilibrio para la disociación de un protón de un ácido en agua se llama
constante de disociación del ácido, Ka. Cuando la reacción llega al equilibrio,
lo que sucede con mucha rapidez, la constante de disociación del ácido es igual
a la concentración de los productos dividida entre la concentración de los
reactivo.
Soluciones amortiguadoras para
resistir cambio de Ph
Las soluciones
amortiguadoras resisten los cambios de pH. En la sangre humana el sistema
amortiguador de dióxido de carbono-ácido carbónico-bicarbonato mantiene
un pH constante de 7.
Constante de disociación de ácidos débiles
COMPRENDERAS MEJOR EN ESTA PAGINA:
https://www.youtube.com/watch?v=YjDVEg84c3k
Proteínas: Estructura tridimensional y funcional
Las
moléculas individuales de proteína se pueden describir mediante hasta
cuatro niveles de estructura:
ESTRUCTURA PRIMARIA:
ESTRUCTURA SECUNDARIAS
ESTRUCTURA TERCIARIA
Las
cadenas polipeptídicas de una proteína oligómera pueden ser idénticas o
distintas.
Métodos para determinar la estructura de las proteínas
 La
técnica acostumbrada para determinar la conformación tridimensional de una proteína
es la cristalografía con rayos X. En
esta técnica se apunta un haz de rayos X colimados, o paralelos, a un cristal
de moléculas de proteína. Los electrones en el cristal difractan los rayos X,
que se registran entonces en una película, o mediante un detector electrónico.
La
técnica acostumbrada para determinar la conformación tridimensional de una proteína
es la cristalografía con rayos X. En
esta técnica se apunta un haz de rayos X colimados, o paralelos, a un cristal
de moléculas de proteína. Los electrones en el cristal difractan los rayos X,
que se registran entonces en una película, o mediante un detector electrónico.
Conformación del
grupo peptídico
Enlaces
de péptido, que unen a los aminoácidos en una cadena polipeptídica.
Los
dos átomos que intervienen en el enlace peptídico, junto con sus cuatro sustituyentes
(el átomo de oxígeno carbonílico, el átomo de hidrógeno de amida y los dos
átomos adyacentes de carbono a) constituyen el grupo peptídico.
Los
análisis cristalográficos de pequeños péptidos con rayos X revelan que el
enlace entre el carbono carbonílico y el nitrógeno es más corto que un enlace
sencillo típico C—N, pero más largo que los dobles enlaces típicos.
Además,
el enlace entre el carbono carbonílico y el oxígeno es un poco mayor que el
doble enlace típico C O. Esas mediciones indican que los enlaces peptídicos
tienen ciertas propiedades del enlace doble y se pueden representar mejor como
un híbrido de resonancia, el grupo peptídico es polar.
El
oxígeno carbonílico presenta una carga negativa parcial y puede servir como
aceptador de hidrógeno en puentes de hidrógeno.
El
nitrógeno cuenta con una carga positiva parcial y el grupo —NH puede servir
como donador de hidrógeno en puentes de hidrógeno.
La
deslocalización electrónica y el carácter parcial de enlace doble del enlace
peptídico evitan que haya rotación libre en torno al enlace C—N.
El
resultado es que los átomos del grupo peptídico están en el mismo plano.
Todavía
es posible la rotación respecto a cada enlace N—Ca y cada enlace Ca en la
columna vertebral repetitiva de N—Ca—C en las proteínas.
Enzimas y Carbohidratos
Cuando un compuesto se transforma en otro, de diferente naturaleza, se ha producido una reacción química. El proceso de transformación ocurre a una determinada velocidad, que depende de varios factores. Así, cuanto mayor sea la cantidad del compuesto inicial más rápido será el proceso.
También influye la temperatura, cuya elevación acelera las reacciones químicas. La
presencia de un catalizador modifica la velocidad de una transformación química
Los seres vivos tienen catalizadores para las reacciones que ocurren en sus células. Se trata de las enzimas, que son proteínas que tienen una actividad catalítica. Todas las transformaciones que ocurren en las células hacen uso de enzimas concretas, habiendo un número incontable de éstas.
Actúan de diferentes modos, pero siempre gracias a que un grupo de aminoácidos, que se encuentran próximos en la estructura espacial de la proteína, facilitan la transformación de que se trate. Estos aminoácidos constituyen lo que se denomina centro activo de la enzima.
La actividad catalítica de muchas enzimas pueden ser reguladas por efectos alostéricos.
Importancia biológica
Es extraordinaria y radica en varias de sus particulares propiedades:
Actúan a muy bajas concentraciones (10-3 a 10-6 moles de enzima/mol de sustrato).
No se consumen en las reacciones.
No modifican el equilibrio del sistema de reacción, sino que sólo influyen sobre la velocidad con que se alcanza tal equilibrio (aumentan la velocidad hasta 106 veces).
Son muy específicas de los sustratos, grupos o enlaces químicos sobre los que actúan.
Actúan siempre a la temperatura del ser vivo.
Actúan siempre a la temperatura del ser vivo.
Presentan un peso molecular elevado, porque son proteínas globulares (solubles en agua, que se difunden muy bien en los líquidos orgánicos).
Su intervención es causa de un notable ahorro energético para las células.
Experimentos cinéticos revelan propiedades de las enzimas
La cinética enzimática proporciona una información indirecta acerca de especificidades y mecanismos catalíticos de las enzimas.
Los experimentos cinéticos también revelan si una enzima está regulada.
Investigaciones revelaron la forma en que las variaciones en las condiciones experimentales o los cambios en la concentración de enzima o sustrato afectan las velocidades de las reacciones.
a. Cinética química
La base de la mayor parte de las mediciones cinéticas es la observación de la rapidez, o velocidad (v), de una reacción, la cual varía en forma directa con la concentración de cada reactante.
Al avanzar una reacción, la cantidad de producto ([P]) aumenta y la cantidad de sustrato ([S]) disminuye.
La única concentración de sustrato es la que se prepara al inicio del experimento.
La velocidad de la reacción en el inicio preciso de la reacción: es el valor que se desea conocer. Este valor representa la velocidad de la reacción a una concentración conocida del sustrato antes de que cambie.
La velocidad inicial (v0) se puede determinar a partir de la pendiente del progreso de las curva o de las derivadas de esas curvas.
La pendiente de la curva es la constante de velocidad.
Constante de velocidad directa (Dirección en avance)
Aplicación de las enzimas en análisis clínicos
Las enzimas se emplean como reactivos estándar en los laboratorios para el diagnóstico de enfermedades, para el control y el seguimiento de enfermedades y de la respuesta del paciente hacia la terapia seguida, y para la identificación y control de la concentración de drogas o sus metabolitos en la sangre u otros fluidos corporales.
Uso de enzimas como productos médicos y farmacéuticos
 Las enzimas, en las aplicaciones médicas y farmacéuticas de las mismas requieren generalmente pequeñas cantidades de enzimas muy purificadas. Esto se debe a que si el destino de una enzima o de un producto obtenido por métodos enzimáticos es su administración a un paciente, resulta evidente que el preparado debe contener las menores cantidades posibles de material extraño para evitar probables efectos secundarios.
Las enzimas, en las aplicaciones médicas y farmacéuticas de las mismas requieren generalmente pequeñas cantidades de enzimas muy purificadas. Esto se debe a que si el destino de una enzima o de un producto obtenido por métodos enzimáticos es su administración a un paciente, resulta evidente que el preparado debe contener las menores cantidades posibles de material extraño para evitar probables efectos secundarios.
Uno de los productos obtenidos mediante el uso de enzimas son los aminoácidos. Si bien se pueden sintetizar empleando un proceso químico, el resultado es una mezcla de dos tipos distintos (D y L isómeros). Puesto que solamente el L-isómero es biológicamente activo, la mezcla debe ser separada en sus dos componentes.
Además de aminoácidos, las enzimas son utilizadas para la producción de antibióticos semi-sintéticos. Las penicilinas semisintéticas son los principales productos farmacéuticos obtenidos por tecnología enzimática.
También se utilizan enzimas en la producción de esteroides. Los esteroides se utilizan en un gran número de preparados farmacéuticos (por ejemplo en los antinflamatorios), por lo que los procesos empleados en la producción de estas sustancias presentan una considerable importancia económica.
Los aminoácidos y la estructura primaria de las proteínas
Estructura general de aminoácidos
Los aminoácidos se llaman así porque son derivados aminados de ácidos carboxílicos. En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos al mismo átomo de carbono: el átomo de carbono a. Así, todos los aminoácidos estándar que contienen las proteínas son a-aminoácidos. Al carbono a se unen otros dos sustituyentes: un átomo de hidrógeno y una cadena lateral (R) que es única para cada aminoácido.
El nombre químico correcto, o nombre sistemático, se apega a reglas establecidas por la Unión Internacional de Química Pura y Aplicada (IUPAC, de International Union of Pure and Applied Chemistry) y la Unión Internacional de Bioquímica y Biología Molecular (IUBMB, de International Union of Biochemistry and Molecular Biology))]. Si el grupo R es —CH3, el nombre sistemático de ese aminoácido sería ácido 2-aminopropanoico. (El ácido propanoico es CH3—CH2—COOH). El nombre trivial de CH3—CH(NH2)—COOH es alanina.
La muestra la estructura general de un aminoácido en perspectiva.
Los átomos de carbono de una cadena lateral se identifican en sucesión como b, g, d y e, que indican los carbonos 3, 4, 5 y 6, respectivamente. El nombre sistemático de la serina es ácido 2-amino-3-hidroxipropanoico. En 19 de los 20 aminoácidos que se usan en la biosíntesis de proteínas, el átomo de carbono a es quiral, o asimétrico, porque tiene cuatro grupos diferentes unidos a él.
La excepción es la glicina, cuyo grupo R sólo es un átomo de hidrógeno (la molécula no es quiral, porque el átomo de carbono a está unida a dos átomos idénticos de hidrógeno).
Los 19 aminoácidos quirales pueden, en consecuencia, existir como estereoisómeros. Los estereoisómeros son compuestos que tienen la misma fórmula molecular pero difieren en el orden o configuración de sus átomos en el espacio. Los dos estereoisómeros son moléculas distintas que no se pueden interconvertir con facilidad entre sí ya que un cambio de configuración requiere romper uno o más enlaces. Los estereoisómeros de aminoácidos no son imágenes especulares (es decir, imágenes en espejo) superponibles; a dichos estereoisómeros se les llama enantiómeros.
Dos de los 19 aminoácidos quirales, la isoleucina y la treonina, presentan dos átomos quirales de carbono cada uno. La isoleucina y la treonina pueden formar, cada una, cuatro estereoisómeros diferentes.
La configuración del aminoácido de la figura 3.1a es L; la de su imagen especular es D. Para asignar la identificación estereoquímica se traza la fórmula del aminoácido en dirección vertical, con su grupo a-carboxilato en la parte superior y su cadena lateral en la parte inferior, ambas alejándose del espectador. En esta orientación, el grupo a-amino del isómero L está a la izquierda del carbono a y el del isómero D está a la derecha.
Estructura de los 20 aminoácidos
Mecanismos enzimáticos
Con técnicas cinéticas se pueden medir los cambios de enlaces químicos de un reactivo o solvente durante la reacción. El estudio de cambios estereoquímicos que suceden durante la reacción puede producir una perspectiva tridimensional del proceso. Para cualquier mecanismo enzimático propuesto, debe coordinarse la información mecanicista de los reactivos y productos intermedios, con la estructura tridimensional de la enzima.
A. Sustituciones nucleofílicas
Muchas reacciones químicas tienen compuestos intermedios iónicos.
Hay dos tipos de intermedios iónicos:
Nucleofílicas: unas especies son ricas en electrones o y otras especies, tiene una carga negativa o un par de electrones no compartido. Suele imaginarse que el nucleófilo ataca al electrófilo, y al mecanismo se le llama ataque nucleofílico, o sustitución nucleofílica.
Electrofílicas: son pobres en electrones.
En general, el mecanismo de una reacción implica un compuesto intermedio.
Otro tipo de sustitución nucleofílica consiste en el: Desplazamiento directo. En este mecanismo, el grupo o molécula atacante se adiciona a la cara del átomo central, opuesto al grupo saliente, y forma un estado de transición que tiene cinco grupos asociados al átomo central. Este estado de transición es inestable y de gran energía. Tiene una estructura entre la del reactivo y la del producto.Ambos tipos de mecanismos de sustitución nucleofílica tienen un estado de transición. En el primer tipo: la reacción procede en forma escalonada, formándose una molécula intermedia que puede tener la estabilidad suficiente para ser detectada.
En el segundo tipo: de mecanismo, la adición del nucleófilos atacante y el desplazamiento del grupo saliente ocurren en forma simultánea. El estado de transición no es un compuesto intermedio estable
B. Reacciones de ruptura
Los enlaces covalentes se pueden romper de dos maneras:
Dos electrones permanecen con un átomo, o un electrón puede permanecer con cada átomo enlazado:
Ambos electrones están en un átomo, por lo que se forman un intermedio iónico y un grupo saliente. Por ejemplo, la ruptura de un enlace C—H casi siempre produce dos iones.
ES DECIR:
Dos electrones permanecen con un átomo, o un electrón puede permanecer con cada átomo enlazado:
Ambos electrones están en un átomo, por lo que se forman un intermedio iónico y un grupo saliente. Por ejemplo, la ruptura de un enlace C—H casi siempre produce dos iones.
ES DECIR:
ü Si el átomo de carbono retiene ambos electrones, el compuesto que lo contiene se transforma en un carbanión.
Si el átomo de carbono pierde ambos electrones, el compuesto que lo contiene se transforma en un ion catiónico llamado carbocatión.
Si el átomo de carbono pierde ambos electrones, el compuesto que lo contiene se transforma en un ion catiónico llamado carbocatión.
2. Un electrón se queda con cada producto, y se forman dos radicales libres que suelen ser muy inestables. (Un radical libre, o radical simplemente, es una molécula o átomo con un electrón no apareado).
C. Reacciones de óxido-reducción
Las reacciones de óxido-reducción son fundamentales en el suministro de energía biológica. En una reacción de óxido-reducción (o reacción redox), los electrones de una especie se transfieren a otra.
Oxidación: es la pérdida de electrones, una sustancia que es oxidada tendrá menos electrones cuando se termine la reacción.
Un agente oxidante es una sustancia que produce una oxidación: toma electrones del sustrato que es oxidado. Así, los agentes oxidantes ganan electrones (es decir, se reducen).
La reducción: es la ganancia de electrones, una sustancia que gana electrones en una reacción es reducida.
Las reacciones de oxidación y reducción siempre suceden en forma simultánea. Un sustrato es oxidado y el otro es reducido.Un agente reductor: es una sustancia que dona o cede electrones (y en el proceso se oxida). Las oxidaciones pueden asumir varias formas, como la eliminación de hidrógeno (deshidrogenación), adición de oxígeno o eliminación de electrones.
La deshidrogenación es la forma más común de oxidación biológica
La reducción: es la ganancia de electrones, una sustancia que gana electrones en una reacción es reducida.
Las reacciones de oxidación y reducción siempre suceden en forma simultánea. Un sustrato es oxidado y el otro es reducido.Un agente reductor: es una sustancia que dona o cede electrones (y en el proceso se oxida). Las oxidaciones pueden asumir varias formas, como la eliminación de hidrógeno (deshidrogenación), adición de oxígeno o eliminación de electrones.
La deshidrogenación es la forma más común de oxidación biológica
Estabilización De Estados De Transición Mediante Catalizadores
El estado de transición: es un arreglo inestable de átomos en el que los enlaces químicos están en proceso de formación o de ruptura. Los estados de transición tienen tiempos de vida extremadamente cortos (de unos 10–14 a 10–13 segundos, que es el tiempo de una vibración de enlace)
El estado de transición ocurre en el máximo de la barrera de activación. Es la cantidad de energía que debe superarse para que se efectúe la reacción. Cuanto más baja sea la barrera, el estado de transición es más estable y la reacción se efectúa con más frecuencia.
La energía que se requiere para llegar al estado de transición a partir del estado basal de los reactivos se llama energía de activación de la reacción, y con frecuencia se le llama barrera de activación.
Los compuestos intermedios, a diferencia de los estados de transición, pueden tener la estabilidad suficiente para poder detectarse o aislarse.
Los catalizadores crean rutas de reacción que tienen menores energías de activación que las de las reacciones no catalizadas. Los catalizadores participan directamente en las reacciones porque estabilizan los estados de transición que hay en las rutas de reacción. Las enzimas son catalizadores que aceleran las reacciones porque disminuyen la energía total de activación. Causan aumento de velocidad al formar una ruta de varios pasos (con uno o varios compuestos intermedios) en el que cada uno de los pasos tiene menor energía de activación que los estados correspondientes en la reacción no enzimática.
Paso en una reacción enzimática:
1. Formación de un complejo no covalente de enzima y sustrato, ES. Cuando
los reactivos se enlazan con las enzimas pierden mucha entropía.
En una reacción entre A y B, la formación del complejo EAB reúne y ubica a los reactivos haciendo que la probabilidad de la reacción catalizada por la enzima sea mucho mayor que la no catalizada.
Una unión correcta con el sustrato explica gran parte del poder catalítico de las enzimas.
2. Los sitios activos de las enzimas enlazan sustratos y productos. También se unen a estados de transición. Es probable que los estados de transición se unan a sitios activos con mucha más fuerza de lo que lo hacen los sustratos.
La unión de sustratos, seguida por la unión de estados de transición, permite tener el máximo aumento de velocidad en la catálisis enzimática.
Modos químicos de la catálisis enzimática
La formación de un complejo ES coloca a los reactivos en la cercanía de residuos de aminoácidos del sitio activo de la enzima. Las cadenas laterales ionizables participan en dos clases de catálisis química: catálisis ácido-base y catálisis covalente, son los dos modos químicos principales de catálisis.
A. Catálisis ácido-base
En la catálisis ácido-base, la aceleración de una reacción se debe a la transferencia catalítica de un protón. Esta catálisis ácido-base es la forma más común de catálisis en química orgánica, y también es común en las reacciones enzimáticas. Las enzimas que la hacen se basan en cadenas laterales de aminoácido que pueden donar y aceptar protones en las condiciones de pH neutro de las células. Este tipo de catálisis ácido-base, donde intervienen agentes de transferencia de protones, se llama catálisis ácido-base general.
Los sitios activos de estas enzimas son el equivalente biológico de una solución de ácido o base. Conviene usar B: para representar a una base o aceptador de protón, y BH para representar su ácido conjugado, un donador de protón. Un aceptor de protón puede ayudar a las reacciones en dos formas. Puede romper los enlaces O—H, N—H, incluso algunos C—H, quitando a un protón.
B. Catálisis covalente
la catálisis covalente se une un sustrato en forma covalente a la enzima y se forma un compuesto intermedio reactivo. La cadena lateral que reacciona de la enzima puede ser un nucleófilo o un electrófilo. La catálisis nucleofílica es más común. En el segundo paso de la reacción se transfiere una porción del sustrato del compuesto intermedio a un segundo sustrato.
Este es un mecanismo común en bioquímica para acoplar dos reacciones diferentes.
aquí les dejo un video de modo de enlazamiento en la catálisis enzimática
VITAMINAS
GENERALIZANDO
Monósacaridos: Es una unidad y ya no se sbdivide en más por hidrolisis ácida o enzimatica.
· Simples: Cadenas de átomos de carbono con varios grupos -OH y un grupo -O.
· Derivados: Monósacaridos modificados.
Oligosacaridos: Formados por la unión de dos, tres o cuatro moléculas de monósacaridos.
Polisacaridos: Son el producto de la unión de numerosas moléculas de monósacaridos.
· Simples: Unión de numerosas moléculas de monóacaridos.
· complejos: Unión de moléculas de monóacaridos derivados.
Disacaridos: Es un carbohidrato formado por dos unidades de monósacaridos, estas unidades estan unidas mediante un enlace glucosidico.
IMPORTANCIA
Los carbohidratos tienen funciones muy diversas en el organismo; desde la transferencia de energía entre las células, como es el caso de la glucosa que es el sustrato energético fundamental y combustible universal para el feto, hasta la función de reconocimiento célular y proteíco pasando por la función de reserva energética bajo la forma y resistencia de los orgánismos vegetales en forma de celulosa. Los carbohidratos pueden ser precursores de lípidos y de factores vitaminicos como el ácido ascorbico y el inositol de determinados organsmo.
AQUI LES PRESENTO UNOS CUANTOS SUPLEMENTOS ALIMENTICIOS.
AQUI LES PRESENTO UNOS CUANTOS SUPLEMENTOS ALIMENTICIOS.
ÁCIDOS NUCLEICOS
Los ácidos nucleicos representan la cuarta gran clase de macromoléculas. Éstas, igual que las proteínas y los polisacáridos, contienen múltiples unidades monoméricas similares que se unen en forma covalente para producir polímeros grandes.
Los nucleótidos son los bloques de construcción de los ácidos nucleicos
Los ácidos nucleicos son polinucleótidos, o polímeros de nucleótidos, tienen tres componentes: un azúcar con cinco carbonos, uno o más grupos fosfato y un compuesto nitrogenado débilmente básico llamado base
Las bases que se encuentran en los nucleótidos son pirimidinas y purinas sustituidas. La pentosa suele ser ribosa (D-ribofuranosa) o 2-desoxirribosa (2-desoxi-D-ribofuranosa). Los N-glicósidos pirimidina o purina de estos azúcares se llaman nucleósidos.
Los nucleótidos son los ésteres de fosfato de los nucleósidos; los nucleótidos comunes contienen uno a tres grupos fosforilo. Los nucleótidos que contienen ribosa se llaman ribonucleótidos, y los que contienen desoxirribosa se llaman desoxirribonucleótidos
A. Ribosa y desoxirribosa
Los dos azúcares aparecen como proyecciones de Haworth de la configuración b de las formas de anillo de furanosa . Es la configuración estable que existe en los nucleótidos y polinucleótidos. Cada uno de esos anillos de furanosa puede adoptar conformaciones diferentes.
B. Purinas y pirimidinas
Las bases que se encuentran en los nucleótidos son derivados de pirimidina o de purinas son compuestos heterocíclicos
La pirimidina
o Tiene un solo anillo de cuatro átomos de carbono y dos de nitrógeno.
o Las principales pirimidinas que hay en los nucleótidos son uracilo (2,4-dioxopirimidina, U), timina (2,4-dioxo-5-metilpirimidina, T) y citosina (2-oxo-4-aminopirimidina, C).
La purina:
o Tiene un sistema de anillos fundidos de pirimidina y de imidazol.
o Las principales purinas son adenina (6-aminopurina, A) y guanina (2-amino-6-oxopurina, G).
Las purinas y pirimidinas sustituidas son ubicuas en las células vivas, pero casi nunca se encuentran las bases no sustituidas en los sistemas biológicos.
La adenina, la guanina y la citosina están en ribonucleótidos y desoxirribonucleótidos. El uracilo se encuentra principalmente en ribonucleótidos y la timina en desoxirribonucleótidos.
Las purinas y las pirimidinas son bases débiles relativamente insolubles en agua al pH fisiológico.
Dentro de las células la mayor parte de bases pirimidina y purina se encuentran como constituyentes de nucleótidos y polinucleótidos, compuestos que son muy hidrosolubles.
Todas las bases en los nucleótidos comunes pueden participar en puentes de hidrógeno.
Todas las bases en los nucleótidos comunes pueden participar en puentes de hidrógeno.
C. NUCLEOSIDO
Los nucleosidos están formados por ribosa y desoxirribosa y una base heterociclica.
Los nucleósidos son derivados N-ribosilo o N-desoxirribosilo de las pirimidinas o las purinas. Los nombres de los nucleósidos se derivan de los de sus base.
o Ejemplo: El ribonucleósido que contiene adenina se llama adenosina, los ribonucleósidos de guanina, citosina y uracilo son guanosina, citidina y uridina, respectivamenteos desoxirribonucleósidos de guanina, citosina y timina son desoxiguanosina, desoxicitidina y desoxitimidina, respectivamente.
Los desoxirribonucleósidos se abrevian dA, dG, dC y dT, cuando es necesario distinguirlos de los ribonucleósidos.
En los nucleósidos de purina, dos conformaciones, syn y anti, están en rápido equilibrio
En los nucleósidos comunes de pirimidina predomina la conformación anti.
En los ácidos nucleicos, que son polímeros de los nucleótidos, predominan las conformaciones anti.
En los ácidos nucleicos, que son polímeros de los nucleótidos, predominan las conformaciones anti.
Los nucleótidos son derivados fosforilados de los nucleósidos.
Los ribonucleósidos contienen tres grupos hidroxilo que se pueden fosforilar y los desoxirribonucleósidos contienen dos de esos grupos hidroxilo.
FORMACIÓN DE UNA DOBLE HÉLICE CON DOS HEBRAS ANTIPARALELAS
La mayor parte de las moléculas de ADN consisten de dos hebras, de polinucleótidos. Cada una de las bases en una hebra forma puentes de hidrógeno con una base de la hebra opuesta
Los pares de bases más comunes están entre los tautómeros lactama y amino de las bases. La guanina se aparea con citosina y la adenina con timina, maximizando los puentes de hidrógeno entre sitios potenciales
La mayor parte de las moléculas de ADN consisten de dos hebras, de polinucleótidos. Cada una de las bases en una hebra forma puentes de hidrógeno con una base de la hebra opuestas
La molécula de ADN se puede visualizar como una “escalera” que se ha torcido para formar una hélice. Las bases apareadas representan los peldaños de la escalera, y los esqueletos de azúcar-fosfato representan los soportes. Cada hebra complementaria sirve como una plantilla perfecta a la otra. Esta complementariedad es responsable de la regularidad general de la estructura del ADN de doble hebra. Sin embargo, el apareamiento de bases complementarias solo no produce una hélice
C. Estabilización de la doble hélice por fuerzas débiles
Las fuerzas que mantienen las conformaciones nativas de las estructuras celulares complejas tienen la fuerza suficiente para mantener las estructuras, pero la debilidad suficiente para permitir que haya flexibilidad de conformación. Los enlaces covalentes entre los residuos adyacentes determinan las formas tridimensionales de esas macromoléculas. Hay cuatro clases de interacciones que afectan la conformación del ADN de doble hebra.
1. Interacciones de apilamiento Los pares de bases apilados forman contactos de van der Waals. Aunque las fuerzas entre los pares de bases individuales apilados son débiles, son aditivas, por lo que en las moléculas grandes de ADN los contactos de van der Waals son una fuente importante de estabilidad.
2. Puentes de hidrógeno. Los puentes de hidrógeno entre pares de bases forman una importante fuerza estabilizadora
3. Efectos hidrofóbicos. Al sepultar los anillos hidrofóbicos de purina y pirimidina en el interior de la doble hélice aumenta la estabilidad de la hélice
4. Interacciones entre cargas. La repulsión electrostática de los grupos fosfato con carga negativa en el esqueleto es una fuente potencial de inestabilidad de la hélice de ADN.
CONFORMACIONES DE ADN DE DOBLE HEBRA
El ADN de doble hebra puede asumir distintas conformaciones bajo condiciones diferentes. Los estudios cristalográficos con rayos X de diversos oligodesoxirribonucleótidos sintéticos, de secuencia conocida, indican que las moléculas dentro de la célula no existen en una conformación B “pura”. En vez de ello, el ADN es una molécula dinámica cuya conformación exacta depende hasta cierto grado de las secuencia de nucleótidos.
DIFERENTES ARN
ÁCIDO RIBONUCLEICO MENSAJERO (ARNm)
Los ARNm son moléculas con un peso molecular muy alto, aunque menor al del ADN. Se encuentran tanto en el núcleo, como en el citoplasma de las células. Su función es la de transportar la información genética almacenada en el núcleo de la célula, en el ADN, hacia el citoplasma que es el sitio en donde se realiza la síntesis de proteínas. Los siguientes incisos están orientados a analizar este proceso.
Figura 15.15 Esquema que representa la estructura del ARN.
ÁCIDO RIBONUCLEICO RIBOSOMAL (ARNr)
Hay cuando menos dos tipos de ARN ribosomal, el cual , como su nombre lo dice, se encuentran formando parte de la estructura de los ribosomas. El ribosoma es el sitio en donde la información que lleva el ARNm es leída para ser traducida a una secuencia de aminoácidos; es en donde se forman las proteínas.
ÁCIDO RIBONUCLEICO DE TRANSFERENCIA (ARNt)
En la bacteria E. coli se han encontrado cuando menos 60 moléculas diferentes de ARNt. El ARNt es el más pequeño de los diferentes tipos de ARN. Estas moléculas tienen la propiedad de unir, en uno de sus extremos, un aminoácido específico. El ARNr reconoce una secuencia de tres bases en el ARNm, permitiendo así el ensamble de los aminoácidos en una secuencia específica, para producir todas las proteínas de una célula. En el ARNt la cadena de polinucleótidos está plegada, de tal forma que algunas de las bases se unen mediante puentes de hidrógeno siguiendo las reglas de apareamiento. En la se aprecia la estructura de un ARN de transferencia.
Figura 15.16 Esquema de la estructura del ARNt.
La síntesis de proteínas
Es un proceso que ocurre en el interior de las células de todos los organismos vivientes. Ocurre en dos etapas: transcripción y traducción. La primera tiene lugar en el núcleo de la célula, la otra en el citoplasma.
La transcripción es el proceso mediante el cual se sintetiza una molécula de ARN (ácido ribonucleico) a partir de un molde de ADN (ácido desoxirribonucleico). La información contenida en los genes -que son secuencias de ADN que se transcriben- es copiada a la molécula de ARN mensajero, la que migrará hacia el núcleo celular para unirse a los ribosomas, orgánulos donde se lleva a cabo la traducción.
En la transcripción participan enzimas y factores de transcripción. Estos últimos estimulan a una enzima llamada ARN polimerasa para que se una a una sección del gen a transcribir llamada promotor. Una vez que la polimerasa se encuentra unida al promotor, la cadena de ADN es abierta (se separan las hebras) ya que ocurre la ruptura de los puentes de hidrógeno que unen las hebras, proceso que ocurre gracias a la actividad helicasa de la ARN polimerasa. Una vez abierto el promotor, la ARN polimerasa se desliza a lo largo de la hebra de ADN que corre en dirección 3' à 5' y se comienza a formar la cadena de ARN por apareamiento de bases complementarias. Así, si en la cadena de ADN se lee una secuencia de AAGGTAG, en la de ARN se copiará la siguiente secuencia: UUCCAUC (dada la complementariedad de bases en el ARN: A=U, C=G). Las bases nitrogenadas en el ARN forman la secuencia en dicha nueva molécula, que es complementaria a la originaria (ADN).
Una vez formado el ARN mensajero, éste migra al núcleo celular tras sufrir breves transformaciones y se acopla a los ribosomas. En el proceso de traducción participan molécula de ARN trasferencial que son los que portan los aminoácidos para formar la nueva proteína. Cada ARN trasferencial posee dos regiones principales: la región aminoacídica, donde porta al aminoácido, y la región anticodón, que contiene un triplete de bases determinado, que es complementario a los codones del ARNm. De este modo, según el condón que se lea en la molécula de ARNm, se colocará un aminoácido determinado en la nueva cadena polipeptídica. En la traducción participan enzimas como la aminoacil-ARNt-sintetasa, encargada de activar los aminoácidos mediante su unión con el ARNt correspondiente, para que estén listos para su agregación lineal en la cadena del nuevo péptido o proteína. En el ribosoma se va leyendo la secuencia de ARNm en tripletes, y por cada triplete (condón) se coloca un aminoácido; la unión entre ellos está mediada por la enzima peptidil transferasa, encargada de formar el enlace peptídico que une los aminoácidos. El proceso de traducción es continuo hasta que se leen los llamados codones de terminación: UAG, UAA, UGA, que le ponen fin.
La nueva cadena polipeptídica sufre algunas transformaciones y luego adopta su conformación tridimensional, volviéndose biológicamente activa. En algunos casos, dichas transformaciones incluyen la adición de grupos prostéticos determinados u otras biomoléculas.
La síntesis de proteínas es un proceso vital para la célula; su cese provocaría la muerte de la misma, ya que ellas catalizan
En la transcripción participan enzimas y factores de transcripción. Estos últimos estimulan a una enzima llamada ARN polimerasa para que se una a una sección del gen a transcribir llamada promotor. Una vez que la polimerasa se encuentra unida al promotor, la cadena de ADN es abierta (se separan las hebras) ya que ocurre la ruptura de los puentes de hidrógeno que unen las hebras, proceso que ocurre gracias a la actividad helicasa de la ARN polimerasa. Una vez abierto el promotor, la ARN polimerasa se desliza a lo largo de la hebra de ADN que corre en dirección 3' à 5' y se comienza a formar la cadena de ARN por apareamiento de bases complementarias. Así, si en la cadena de ADN se lee una secuencia de AAGGTAG, en la de ARN se copiará la siguiente secuencia: UUCCAUC (dada la complementariedad de bases en el ARN: A=U, C=G). Las bases nitrogenadas en el ARN forman la secuencia en dicha nueva molécula, que es complementaria a la originaria (ADN).
Una vez formado el ARN mensajero, éste migra al núcleo celular tras sufrir breves transformaciones y se acopla a los ribosomas. En el proceso de traducción participan molécula de ARN trasferencial que son los que portan los aminoácidos para formar la nueva proteína. Cada ARN trasferencial posee dos regiones principales: la región aminoacídica, donde porta al aminoácido, y la región anticodón, que contiene un triplete de bases determinado, que es complementario a los codones del ARNm. De este modo, según el condón que se lea en la molécula de ARNm, se colocará un aminoácido determinado en la nueva cadena polipeptídica. En la traducción participan enzimas como la aminoacil-ARNt-sintetasa, encargada de activar los aminoácidos mediante su unión con el ARNt correspondiente, para que estén listos para su agregación lineal en la cadena del nuevo péptido o proteína. En el ribosoma se va leyendo la secuencia de ARNm en tripletes, y por cada triplete (condón) se coloca un aminoácido; la unión entre ellos está mediada por la enzima peptidil transferasa, encargada de formar el enlace peptídico que une los aminoácidos. El proceso de traducción es continuo hasta que se leen los llamados codones de terminación: UAG, UAA, UGA, que le ponen fin.
La nueva cadena polipeptídica sufre algunas transformaciones y luego adopta su conformación tridimensional, volviéndose biológicamente activa. En algunos casos, dichas transformaciones incluyen la adición de grupos prostéticos determinados u otras biomoléculas.
La síntesis de proteínas es un proceso vital para la célula; su cese provocaría la muerte de la misma, ya que ellas catalizan
AQUI LES DEJO UN PEQUEÑO VIDEO DE LOS ACIDOS NUCLEICOS Y SINTESIS EN GENERAL.
LÍPIDOS Y MEMBRANAS
 Los lípidos en una bicapa están en movimiento constante, dando a las bicapas lipídicas muchas de las propiedades de los fluidos. Los lípidos tienen varios tipos de movimiento molecular dentro de las bicapas. El rápido movimiento de los lípidos dentro del plano de una monocapa es un ejemplo de difusión lateral bidimensional.
Los lípidos en una bicapa están en movimiento constante, dando a las bicapas lipídicas muchas de las propiedades de los fluidos. Los lípidos tienen varios tipos de movimiento molecular dentro de las bicapas. El rápido movimiento de los lípidos dentro del plano de una monocapa es un ejemplo de difusión lateral bidimensional.
2. Secuestradores de Ácido Bílico
5. Zetia (Ezetimibe)
Usted debe tomar estatinas si tiene 75 años o menos y tiene antecedentes de:
Los lípidos una tercera gran clase de macromoléculas. Como las proteínas y los carbohidratos, los lípidos son componentes esenciales de todos los organismos vivos. Los mismos poseen unas estructuras muy variadas. Se definen como compuestos orgánicos insolubles en agua que se encuentran en los sistemas biológicos.
Los lípidos tienen gran solubilidad en solventes orgánicos no polares, son hidrofóbicos (no polares) o bien son anfipáticos.
GENERALIDADES
DIVERSIDAD ESTRUCTURAL Y FUNCIONAL DE LOS LÍPIDOS
Los Lípidos Simples son: los ácidos grasos, y tienen la fórmula general R—COOH, donde R representa una cadena de hidrocarburo.
Los ácidos grasos son: incluyendo los triglicéridos o triacilgliceroles, los glicerofosfolípidos y los esfingolípidos.
Los lípidos que contienen:
1. Grupos fosfato: fosfolípidos
2. Grupos esfingosina y carbohidrato a la vez : glicoesfingolípidos
3. Los esteroides, las vitaminas lipídicas y los terpenos se relacionan con la molécula de isopreno, de cinco carbonos: isoprenoides.
Las membranas biológicas contienen una variedad de lípidos anfipáticos, incluyendo: los glicerofosfolípidos y los esfingolípidos.
ALGUNAS FUNCIONES DE LOS LÍPIDOS:
1. La función de los triacilgliceroles (grasas y aceites) es de moléculas intracelulares de almacenamiento de energía metabólica.
2. Las grasas suministran aislamiento térmico y amortiguamiento a los animales.
3. Las ceras en las paredes celulares, en los exoesqueletos y en la piel protegen a las superficies de algunos organismos.
4. Funciones muy especializadas: las hormonas esteroides regulan e integran una variedad de actividades metabólicas en los animales, y los icosanoides participan en la regulación de: la presión sanguínea, en la temperatura corporal y en la contracción de los músculos lisos en los mamíferos.
5. Los gangliósidos y otros glicoesfingolípidos están en la superficie celular y pueden participar en el reconocimiento celular.
ÁCIDOS GRASOS
Los ácidos grasos difieren entre sí en la longitud de sus colas de hidrocarburo, la cantidad de dobles enlaces carbono-carbono, las posiciones de los dobles enlaces en las cadenas y la cantidad de ramificaciones.
Los ácidos grasos tienen un pKa aproximado de 4.5 a 5.0, y por consiguiente están ionizados al pH fisiológico.
Los ácidos grasos son una forma de detergente, porque tienen una larga cola hidrofóbica y una cabeza polar
Concentración de ácido graso libre en las células es muy baja, porque altas concentraciones de ácidos grasos libres podrían romper las membranas.
La mayor parte de los ácidos grasos están formados por lípidos más complejos. Están unidos a otras moléculas mediante un enlace de éster en el grupo carboxilo terminal
La cantidad de átomos de carbono en los ácidos grasos más abundantes va de 12 a 20.
Identificación de Ácidos Grasos
1. Una notación taquigráfica para identificar los ácidos grasos usa dos números separados por dos puntos (:); el primero indica la cantidad de átomos de carbono en el ácido graso, y el segundo, la cantidad de dobles enlaces carbono-carbono,
2. También se pueden especificar los ácidos grasos no saturados por la localización del último doble enlace de la cadena.
LAS PROPIEDADES FÍSICAS DE LOS ÁCIDOS GRASOS SATURADOS Y NO SATURADOS
1. Temperatura:
Los ácidos grasos saturados son sólidos céreos a temperatura ambiente (22 °C
Los ácidos grasos no saturados son líquidos a esta temperatura.
Punto de Fusión:
La longitud de la cadena de hidrocarburo en un ácido graso, y su grado de insaturación, influyen sobre el punto de fusión.
A medida que aumentan las longitudes de las colas de hidrocarburo, también aumentan los puntos de fusión de los ácidos grasos saturados.
Los ácidos grasos no saturados cis tienen menores puntos de fusión que los ácidos grasos saturados.
Grado de instauración
A medida que aumenta el grado de insaturación, los ácidos grasos se vuelven más fluidos.
Ejemplo:
El ácido esteárico (punto de fusión 70 °C) es un sólido a la temperatura del organismo, en tanto que el ácido oleico (punto de fusión 13 °C)
El ácido linolénico (punto de fusión –17 °C) son líquidos.
La abundancia relativa de determinados ácidos grasos varía de acuerdo con el tipo de organismo, su órgano (en los organismos multicelulares) y su fuente alimenticia
Los ácidos grasos más abundantes en los animales
Ser oleato (18:1) palmitato (16:0) y estearato (18:0). Los mamíferos requieren ciertos ácidos grasos poliinsaturados en su dieta, que no pueden sintetizar, como linoleato (18:2), abundante en los aceites vegetales, y linolenato (18:3), que abunda en aceites vegetales y de pescado. Esos ácidos grasos se llaman ácidos grasos esenciales.
Los mamíferos pueden sintetizar otros ácidos grasos poliinsaturados si tienen un suministro adecuado de linoleato y linolenato.
TRIACILGLICEROLES
Los ácidos grasos se almacenan en forma de lípidos neutros llamados triacilgliceroles o triglicéridos (este último nombre es histórico están formados por tres residuos de acilo graso esterificados con glicerina, un azúcar alcohol de tres carbonos .
Las grasas y los aceites son mezclas de triacilgliceroles. Pueden ser sólidos (grasas) o líquidos (aceites), dependiendo de sus composiciones de ácidos grasos y de la temperatura.
Una muestra de triacilgliceroles naturales puede contener hasta 20 o 30 especies moleculares que difieren en la composición de sus ácidos grasos
La tripalmitina, en las grasas animales, contiene tres residuos de ácido palmítico.
La mayor parte de los lípidos en la dieta humana promedio son triacilgliceroles.
DIGESTION DE LOS LIPIDOS
Esos lípidos se descomponen en el intestino delgado por acción de las lipasas. Esas enzimas se sintetizan como zimógenos en el páncreas, y son secretadas en el intestino delgado, donde se activan. La lipasa pancreática cataliza la hidrólisis de los ésteres primarios (en el C-1 y C-3) de los triacilgliceroles, liberando los ácidos grasos y generando monoacilgliceroles.
Como los lípidos no son solubles en el agua, la digestión de los lípidos se lleva a cabo en presencia de detergentes enérgicos, llamados sales biliares que son derivados anfipáticos del colesterol. Las micelas de las sales biliares solubilizan los ácidos grasos y los monoacilgliceroles, de tal modo que se pueden difundir y ser absorbidos por las células de la pared intestinal.
Los lípidos se transportan por el organismo en forma de complejos de lípido y proteína, llamados lipoproteínas.
Glicerofosfolípidos
Los lípidos más abundantes en la mayor parte de las membranas son los glicerofosfolípidos (fosfoglicéridos) como los triacilgliceroles tienen un soporte de glicerol.
Los glicerofosfolípidos más sencillos, los fosfatidatos, consisten en dos grupos acilo graso esterificados en el C-1 y C-2 del 3-fosfato de glicerol.
Los fosfatidatos están presentes en pequeñas cantidades como intermedios en la biosíntesis o descomposición de glicerofosfolípidos más complejos. En la mayor parte de los glicerofosfolípidos, el grupo fosfato está esterificado con glicerol y otro compuesto que tenga un grupo —OH.
Los glicerofosfolípidos: fosfatidiletanolamina, fosfatidilserina y fosfatidilcolina. Cada tipo de glicerofosfolípido consiste en una familia de moléculas con el mismo grupo en la cabeza polar, y distintas cadenas de acilo graso.
En general, los glicerofosfolípidos tienen ácidos grasos saturados esterificados en el C-1 y ácidos grasos no saturados esterificados en el C-2.
Para determinar las estructuras de los glicerofosfolípidos y las identidades de sus ácidos grasos individuales se puede usar una diversidad de fosfolipasas. Las posiciones específicas de ácidos grasos en los glicerofosfolípidos se pueden determinar usando fosfolipasa A1 y fosfolipasa A2, que catalizan en forma específica la hidrólisis de los enlaces de éster en el C-1 y C-2, respectivamente.
La fosfolipasa A2 es la principal en el jugo pancreático, y es la responsable de la digestión de fosfolípidos de membrana en la dieta. También está presente en los venenos de víbora, abeja y avispa.
Altas concentraciones de los productos de la fosfolipasa A2 pueden romper las membranas celulares.
La otra clase principal de glicerofosfolípidos es la de los plasmalógenos, y difiere de los fosfatidatos porque tiene el sustituyente hidrocarburo en el grupo hidroxilo del C-1 de la glicerina, unido por un enlace de éter vinílico, y no enlace de éster
ESFINGOLÍPIDOS
Los lípidos más abundantes en las membranas vegetales y animales son los esfingolípidos.
En los mamíferos tienen abundancia especial en tejidos del sistema nervioso central. La mayor parte de las bacterias no tienen esfingolípidos.
Las ceramidas son los precursores metabólicos de todos los esfingolípidos.
Las tres grandes familias de esfingolípidos son: las esfingomielinas, los cerebrósidos y los gangliósidos.
Las esfingomielinas: contienen fosfato, y se clasifican como fosfolípidos; los cerebrósidos y los gangliósidos contienen residuos de carbohidrato y se clasifican como glicoesfingolípidos. Las esfingomielinas existen en las membranas plasmáticas de la mayor parte de las células de mamíferos, y son componente principal de las vainas de mielina que rodean a ciertas células nerviosas.
Los galactocerebrósidos abundan en el tejido nervioso, y forman casi el 15% de los lípidos en las vainas de mielina. Muchos otros tejidos en los mamíferos contienen glucocerebrósidos, ceramidas con un grupo b-D-glucosilo en la cabeza.
Los defectos genéticamente heredados en el metabolismo de gangliósidos son los responsables de varias enfermedades debilitantes, y con frecuencia letales, como la enfermedad de Tay-Sachs y la gangliosidosis (o gangliósido lipidosis) generalizada. Ciertos defectos genéticos raros provocan deficiencias de enzimas responsables de la degradación de esfingolípidos en los lisosomas celulares. En la enfermedad de Tay-Sachs hay deficiencia de una hidrolasa que cataliza la eliminación de N-acetilgalactosamina de GM2. La acumulación de GM2 hace que los lisosomas se hinchen y los tejidos se agranden. En el tejido nervioso central, donde hay poco espacio para la expansión, mueren las células nerviosas; eso provoca ceguera, retardo mental y muerte.
ESTEROIDES
Los esteroides son una tercera clase de lípidos que se encuentran en las membranas de los eucariotas, y muy rara vez en las bacterias.
Los esteroides, junto con las vitaminas lipídicas y los terpenos, se clasifican como isoprenoides porque sus estructuras se relacionan con la molécula de isopreno, de cinco carbonos. Los esteroides contienen cuatro anillos fundidos, tres de seis carbonos identificados como A, B y C, y un anillo D de cinco carbonos. La estructura anular característica se deriva del escualeno
En realidad, el colesterol es un esterol porque tiene un grupo hidroxilo en el C-3.
Otros esteroides son los de las plantas, hongos y levaduras
Poseen:
ü Un grupo hidroxilo en el C-3.
ü Las hormonas esteroides de mamíferos (como estrógenos, andrógenos, progestinas y corticosteroides suprarrenales).
ü Y las sales biliares.
Estos esteroides difieren en la longitud de la cadena lateral unida al C-17, y en la cantidad y colocación de grupos metilo, dobles enlaces, grupos hidroxilo y, en algunos casos, grupos ceto.
Las membranas procarióticas contienen escualeno y algunos lípidos no esteroides relacionados que no tienen la estructura anular completa de los esteroides.
El colesterol se acumula con frecuencia en depósitos lipídicos (placas) en las paredes de los vasos sanguíneos. Se han identificado esas placas en las enfermedades cardiovasculares, que pueden provocar ataques al corazón. Muchas personas limitan su ingestión de colesterol. A pesar de su implicación en enfermedades cardiovasculares, el colesterol tiene participación esencial en la bioquímica de los mamíferos. Es sintetizado por las células de mamíferos. No sólo es un componente de ciertas membranas, sino también un precursor esencial de las hormonas esteroides y de las sales biliares. El sistema de anillos fundidos del colesterol, que se ve al lado de lo hace menos flexible que la mayor parte de los demás lípidos. El resultado es que el colesterol modula la fluidez de las membranas celulares de mamíferos, como se verá más adelante en este capítulo. Como el grupo hidroxilo en el C-3 es su único componente polar, el colesterol es mucho más hidrofóbico que los glicerofosfolípidos y los esfingolípidos.
El colesterol se convierte en ésteres de colesterilo para su almacenamiento en las células, o para su transporte en el torrente sanguíneo. Como son en esencia insolubles en agua, el colesterol y sus ésteres deben acomplejarse con fosfolípidos y proteínas anfipáticas en lipoproteínas para su transporte
OTROS LÍPIDOS DE IMPORTANCIA BIOLÓGICA
Hay muchas clases de lípidos que no se encuentran en las membranas.
Incluyen distintos compuestos como: ceras, eicosanoides e isoprenoides.
Las ceras:
Son ésteres no polares de ácidos grasos de cadena larga y alcoholes monohidroxílicos de cadena larga.
Proporcionan cubiertas protectoras impermeables a las hojas y frutos de ciertas plantas, y en la piel, cuero, plumas y exoesqueletos de animales.
La cera de oídos, llamada también cerumen o cerilla, es secretada por las células que cubren el conducto auditivo. Lubrica el conducto y atrapa partículas que podrían dañar al tímpano. La cera de oídos es una mezcla compleja, formada principalmente por ácidos grasos de cadena larga, colesterol y ceramidas. También contiene escualeno, triacilgliceroles y ceras verdaderas (10% del peso).
Los eicosanoides:
Son derivados oxigenados de ácidos grasos poliinsaturados de C20, como ácido araquidónico.
Éstos participan en una diversidad de procesos fisiológicos, y también pueden mediar muchas respuestas potencialmente patológicas. Las prostaglandinas son eicosanoides que tienen un anillo de ciclopentano. La prostaglandina E2 puede causar constricción de vasos sanguíneos, y el tromboxano A2 interviene en la formación de coágulos sanguíneos, que en algunos casos pueden bloquear el flujo de sangre al corazón o al cerebro. El leucotrieno D4, mediador de la contracción de músculos lisos, también provoca la constricción bronquial de los asmáticos. La aspirina (ácido acetilsalicílico) alivia el dolor, la fiebre, la hinchazón y la inflamación, al inhibir la síntesis de las prostaglandinas. Algunos de los lípidos no de membrana se relacionan con el isopreno pero no son esteroides.
1. Las vitaminas lipídicas A, E y K son isoprenoides
Que contienen largas cadenas de hidrocarburo o anillos fundidos.
La vitamina D es un isoprenoide derivado del colesterol. Hay varios carotenos relacionados con el retinol (vitamina A). La cadena hidrofóbica de la ubiquinona contiene de 6 a 10 unidades de isoprenoide
Los lípidos determinan las propiedades físicas de la membrana, pero no son los únicos elementos estructurales.
Funciones: determinan la organización de la membrana, la fluidez, contribuyen al gradiente eléctrico, pueden actuar como segundos mensajeros, pueden producir segregaciones funcionales en las proteínas de membrana.
Representan aproximadamente el 50 % del peso de la membrana. Tipos: glicerofosfolípidos, esfingolípidos y esteroles.
Funciones: determinan la organización de la membrana, la fluidez, contribuyen al gradiente eléctrico, pueden actuar como segundos mensajeros, pueden producir segregaciones funcionales en las proteínas de membrana.
Representan aproximadamente el 50 % del peso de la membrana. Tipos: glicerofosfolípidos, esfingolípidos y esteroles.
LAS MEMBRANAS BIOLÓGICAS ESTÁN FORMADAS POR BICAPAS LIPÍDICAS Y PROTEÍNAS
Una membrana típica está formada por dos capas de moléculas de: lípidos y muchas proteínas embebidas en ella.
Las membranas biológicas no sólo son barreras pasivas contra la difusión, funciones:
- Bombas selectivas que controlan en forma estricta el transporte de iones y de moléculas pequeñas que entran y salen de la célula.
- Las membranas también son responsables de generar y mantener la concentración de gradientes de protones, esenciales para la producción de ATP.
- Los receptores en las membranas reconocen señales extracelulares y las comunican al interior de la célula, muchas células tienen membranas con estructuras especializadas.
- El líquido en el espacio periplásmico entre estas dos membranas contiene proteínas que conducen a solutos específicos hacia proteínas de transporte en la membrana interna. A los solutos atraviesan la membrana interna mediante un proceso dependiente de ATP.
Una membrana externa lisa de una mitocondria tiene proteínas que forman canales acuosos; su membrana interna convolucionada (sinuosa) es permeable en forma selectiva, y tiene muchas enzimas unidas a la membrana. El núcleo también tiene una membrana doble
A. Las bicapas lipídicas La formación espontánea de bicapas lipídicas es impulsada por las interacciones hidrofóbicas Cuando se asocian las moléculas de lípido, la entropía de las moléculas de solvente aumenta y eso favorece la formación de la bicapa lipídica.
B. Modelo fluido Los lípidos son una mezcla compleja de fosfolípidos, glicoesfingolípidos (en animales) y colesterol (en algunos eucariotas). El colesterol y algunos otros lípidos que por sí no forman bicapas (30% del total) están estabilizados en el arreglo de bicapa por el otro 70% de los lípidos en la membrana. Las composiciones de las membranas biológicas varían en forma considerable entre las especies, y aun entre distintos tipos celulares en organismos multicelulares.
La membrana plasmática de los glóbulos rojos también es excepcionalmente rica en proteínas. Además de tener una relación característica de lípido a proteína, cada membrana biológica tiene una composición característica de lípidos.
Por ejemplo:
- Las membranas en el tejido cerebral tienen un contenido : alto de fosfatidilserinas.
- Las membranas en el corazón y los pulmones tienen: altas concentraciones de fosfatidilglicerol y esfingomielinas,
LAS BICAPAS LIPÍDICAS Y LAS MEMBRANAS SON ESTRUCTURAS DINÁMICAS
En contraste, la difusión transversal es el paso de lípidos de una monocapa de la bicapa a la otra. La difusión transversal es mucho más lenta que la lateral. La cabeza polar de una molécula de fosfolípido está muy solvatada y debe desprenderse de su esfera de solvatación y penetrar al interior del hidrocarburo en la bicapa, para moverse de una hojilla a la otra.
Todas las células sintetizan membranas nuevas agregando lípidos y proteínas a sus membranas existentes. Al extenderse la membrana plasmática, la célula aumenta de tamaño. Al final, la célula se dividirá y cada célula hija heredará una parte (por lo regular la mitad) de las membranas progenitoras. Las membranas internas se extienden y dividen de la misma manera.
La asimetría lipídica también puede generarse y conservarse con la actividad de flipasas y flopasas (de flip-flop diffusion, o difusión transversal) unidas a la membrana; son enzimas que usan la energía del ATP para mover fosfolípidos específicos de una monocapa a la otra. La actividad de estas enzimas explica el enriquecimiento de ciertos tipos de fosfolípido en la capa externa. Las células eucarióticas fabrican sus lípidos de membrana en una reestructuración asimétrica en el retículo endoplásmico del aparato de Golgi. Los fragmentos de membrana van desde estos organelos, conservando la asimetría, a otras membranas.
Las membranas biológicas, que contienen una mezcla heterogénea de lípidos, cambian en forma gradual de gel a la fase de cristal líquido, en forma típica dentro de un intervalo de temperatura de 10 a 40 °C.
La estructura de un fosfolípido tiene efectos notables sobre su fluidez y su temperatura de transición de fase.
El colesterol tiende a asociarse con los esfingolípidos, porque tienen largas cadenas de ácido graso saturado. Las cadenas no saturadas de la mayor parte de los glicerofosfolípidos producen arrugas que no admiten con facilidad moléculas de colesterol en la membrana. Debido a esta asociación preferente, las membranas de mamíferos están formadas por parches de regiones de colesterol/esfingolípido, rodeadas por regiones que tienen muy poco colesterol. Esos parches se llaman balsas de lípido. Ciertas proteínas de membrana se pueden asociar en forma preferente a las balsas de lípido. Así, algunas proteínas de membrana también pueden tener una distribución de parches sobre la superficie celular. Se cree que las proteínas de membrana tienen un papel importante en la conservación de la integridad de las balsas de lípido.
TRES CLASES DE PROTEÍNAS DE MEMBRANA
Las membranas celulares e intracelulares contienen proteínas especializadas enlazadas en la membrana. Esas proteínas se dividen en tres clases, según su modo de asociación con la bicapa lipídica:
TRANSPORTE DE MEMBRAN
Las membranas son barreras de permeabilidad selectiva que restringen el paso libre de la mayor parte de las moléculas
Las moléculas más grandes, como las de proteínas y ácidos nucleicos, también deben transportarse atravesando las membranas, incluyendo las que hay entre compartimientos. Las moléculas hidrofóbicas y las moléculas pequeñas sin carga pueden difundirse libremente a través de las membranas biológicas, pero el interior hidrofóbico de la bicapa presenta una barrera casi impenetrable frente a la mayor parte de las especies polares o cargadas.
La velocidad del movimiento depende de la diferencia de concentraciones, o gradiente de concentración, entre los dos lados. La difusión gradiente abajo de concentración (es decir, difusión cuesta abajo) es un proceso espontáneo impulsado por aumento de entropía, y por consiguiente disminución de energía libre. El tráfico de moléculas polares y de iones a través de las membranas es mediado por tres tipos de proteínas integrales de membrana: canales y poros, transportadores pasivos y transportadores activos. Esos sistemas de transporte tienen distintas propiedades cinéticas y necesidades de energía.
EXISTEN DIFERNETES MEDICAMETOS PARA CONVATIR ENFERMEDADES PRODUCIDAS POR LIPIDOS, ALGUNO DE ELLOS SON:
- Estatinas
- Secuestradores de Ácido Bílico
- Niacina
- Derivados de Ácido Fíbrico
- Zetia (Ezetimibe)
1. Estatinas (Inhibidores de Reductasa HMG CoA)
Estas disminuyen los niveles de colesterol total, colesterol LDL, y triglicéridos. Éstos también podrían reducir los riesgos de enfermedades cardiacas. Los medicamentos por lo general se toman diariamente con la cena o en la noche. Su médico medirá sus niveles de colesterol en la sangre y su función hepática regularmente mientras usted está tomando estos medicamentos.
Incluso si actualmente no tiene enfermedad conocida de las arterias coronarias (CHD), usted se podría beneficiar de tomar medicamentos de estatinas (reductores de colesterol), particularmente si sus niveles de colesterol son elevados. En una revisión reciente de siete estudios clínicos, sujetos sin CHD conocida que tomaron estatinas durante al menos un año tuvieron una reducción considerable.
Nombres comunes incluyen:
· Fluvastatina (Lescol)
· Atorvastatina (Lipitor) (figura 1)
· Lovastatina (Mevacor)(figura 2)
· Pravastatina (Pravachol)
· Simvastatina (Zocor)
· Rosuvastatina (Crestor)
2. Secuestradores de Ácido Bílico
Los secuestradores de ácido bílico reducen los niveles de colesterol al cambiar la manera en la que se metaboliza el colesterol. Los medicamentos vienen en forma de polvo y se toman con los alimentos para reducir los efectos secundarios. Éstos no se deberían tomar dentro de las horas en las que esté tomando algún otro medicamento. Por lo general, estos medicamentos se toman ya sea una hora antes o cuatro horas después de tomar algún otro medicamento.
Posibles efectos secundarios incluyen: Acidez estomacal, Distensión, Estreñimiento
Nombres comunes incluyen:
·Colestiramina (Questran)
·Colestipol (Colestid) (10)
3. Niacina o Ácido Nicotínico
3. Niacina o Ácido Nicotínico
La niacina es una vitamina B. En dosis más altas, puede reducir los niveles de colesterol y triglicéridos. No se sabe cómo funciona. La niacina se debería tomar con los alimentos, dos o tres veces al día, o una vez al día con la pastilla de liberación prolongada.
Posibles efectos secundarios incluyen: Enrojecimiento,Comezón, Sarpullido, Malestar del sistema digestivo
4. Derivados de Ácido Fíbrico
4. Derivados de Ácido Fíbrico
Nombres comunes incluyen:
- Gemfibrozilo (Lopid) (figura 4)
- Fenofibrato (Lofibra)
Los derivados de ácido fíbrico por lo general se toman para reducir los niveles de triglicéridos e incrementar el colesterol HDL. Éstos también podrían ayudar a reducir el colesterol LDL.
Posibles efectos secundarios incluyen: Dolor abdominal,Náusea,Diarrea, Sarpullido Comezón, Cálculos biliares.
5. Zetia (Ezetimibe)
Ezetimibe reduce el colesterol total y el colesterol LDL (malo). Funciona mediante un mecanismo diferente al de las estatinas al reducir la cantidad de colesterol que su cuerpo absorbe.
Posibles efectos secundarios incluyen: Dolor abdominal, Fatiga, Reacción alérgica (inflamación del rostro, labios, lengua, o garganta que podría causar dificultad para respirar), Sarpullido
Tratamiento farmacológico para el colesterol
Su cuerpo necesita el colesterol para funcionar apropiadamente. Pero el colesterol extra en la sangre provoca depósitos que se acumulan en las paredes internas de los vasos sanguíneos. Esta acumulación se llama placa. Esta placa estrecha las arterias y educe o detiene la circulación. Esto puede llevar a un ataque cardíaco, un accidente cerebrovascular o un estrechamiento de las arterias en otra parte del cuerpo.
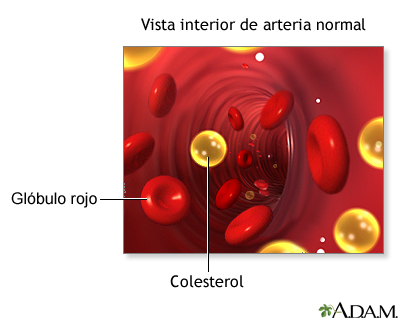

Se cree que las estatinas son los mejores fármacos para usarlos en personas que necesitan medicamentos para bajar su colesterol.


Se cree que las estatinas son los mejores fármacos para usarlos en personas que necesitan medicamentos para bajar su colesterol.
Estatinas para el colesterol
Las estatinas reducen el riesgo de cardiopatía, accidente cerebrovascular y otros problemas conexos. Ellas hacen esto al disminuir el colesterol LDL (malo).
La mayoría de las veces, usted necesitará tomar este medicamento por el resto de su vida. En algunos casos, cambiar su estilo de vida y perder el peso extra pueden permitirle que deje de tomar este medicamento.
La mayoría de las veces, usted necesitará tomar este medicamento por el resto de su vida. En algunos casos, cambiar su estilo de vida y perder el peso extra pueden permitirle que deje de tomar este medicamento.
¿Quién debe tomar estatinas para bajar el colesterol?
El médico decidirá sobre su tratamiento basado en:
- Sus niveles de colesterol total, HDL (bueno) y LDL (malo).
- Su edad.
- Sus antecedentes de diabetes, presión arterial alta o cardiopatía.
- Otros problemas de salud que puedan ser causados por el colesterol alto.
- Si fuma.
- Su riesgo de cardiopatía.
- Su etnia.
- Problemas cardíacos debido al estrechamiento de las arterias en el corazón.
- Accidente cerebrovascular o AIT (miniaccidente cerebrovascular).
- Aneurisma aórtico (una protuberancia en la arteria principal del cuerpo).
- Estrechamiento de las arterias de las piernas.
- Si es mayor de 75 años, el médico puede recetarle una dosis menor de una estatina. Esto puede ayudar a disminuir los efectos secundarios.
- Tiene diabetes y está entre las edades de 40 y 75 años.
- Tiene diabetes y un alto riesgo de cardiopatía.
- Tiene un alto riesgo de cardiopatía.
- Tiene diabetes y un nivel de riesgo medio para cardiopatía.
- Tiene un nivel de riesgo medio para cardiopatía.
CUIDA TU SALUD.





























